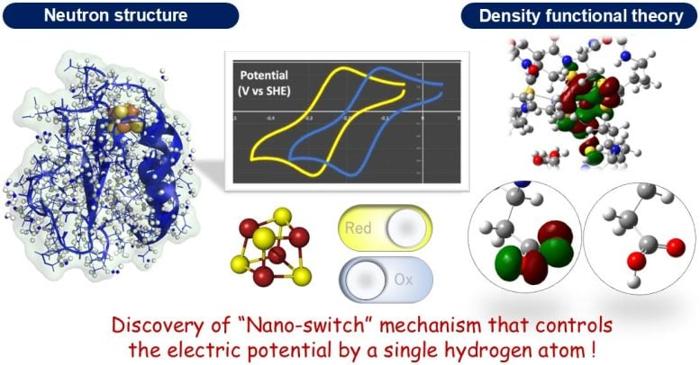
Un recente studio condotto in Giappone ha portato alla luce un interessante “nano-switch” all’interno della ferredossina, una scoperta che potrebbe avere importanti implicazioni nel campo dei sensori e nello sviluppo di farmaci. I ricercatori hanno individuato un meccanismo che regola il potenziale di una proteina coinvolta nel trasporto degli elettroni durante le reazioni redox fondamentali per l’ottenimento di energia in tutti gli organismi.
Attraverso una serie di esperimenti accurati, è stata possibile determinare la struttura tridimensionale della proteina, inclusi gli atomi di idrogeno, e grazie a calcoli teorici basati su questi dati è stato possibile visualizzare la struttura elettronica del cluster ferro-zolfo. I risultati hanno rivelato un aspetto inedito: il potenziale elettrico del cluster ferro-zolfo può variare notevolmente in base alla presenza o all’assenza di un singolo atomo di idrogeno su una catena laterale di amminoacidi, un fenomeno definito “nano-switch”.
Questo studio, pubblicato di recente sulla rivista scientifica eLife, non solo contribuisce alla nostra comprensione delle reazioni biologiche, ma fornisce anche spunti fondamentali per lo sviluppo futuro di sensori altamente sensibili per il monitoraggio di ossigeno e ossido nitrico, nonché per la progettazione di nuovi farmaci.
La ferredossina è una proteina di dimensioni ridotte che contiene cluster ferro-zolfo e svolge un ruolo cruciale nel trasporto degli elettroni negli organismi viventi.
Questa proteina è ampiamente diffusa in natura e il suo meccanismo di trasporto degli elettroni è stato a lungo oggetto di studio e mistero.
Grazie ai progressi nella biologia strutturale, i ricercatori sono riusciti a condurre esperimenti utilizzando tecnologie avanzate presso il Japan Proton Accelerator Research Complex (J-PARC) per determinare la struttura tridimensionale dettagliata della ferredossina a livello atomico di idrogeno. La visualizzazione degli atomi di idrogeno nelle molecole proteiche tramite neutroni è una sfida tecnica notevole, e solo una piccola percentuale del database mondiale delle strutture proteiche ha raggiunto questo traguardo.
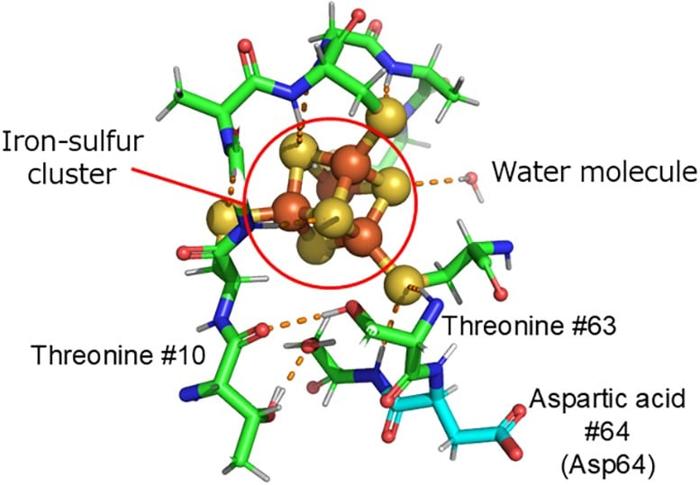
Attraverso calcoli teorici basati sui dati sperimentali, è emerso che un particolare residuo di amminoacido, l’acido aspartico 64, situato in prossimità del cluster ferro-zolfo, ha un ruolo determinante nel controllo del trasferimento degli elettroni nella ferredossina, agendo come un vero e proprio interruttore che regola questo processo fondamentale. Questo meccanismo è stato dimostrato essere universale in diversi organismi, ampliando ulteriormente l’importanza di questa scoperta.







