La tavola periodica, se osservata oggi, sembra completa con il settimo periodo completato dal 2010, ma l’ottavo periodo non è ancora iniziato. Ci si potrebbe chiedere se abbiamo scoperto o creato tutti gli elementi possibili, e se esista un limite oltre il quale non sia possibile crearne altri. In realtà, non sembra esserci un limite definitivo, ma ci sono interessanti complicazioni da considerare.
Per capire meglio, è importante ricordare che gli elementi sono definiti dal numero di protoni nel loro nucleo. Ad esempio, sei protoni corrispondono al carbonio, 26 al ferro e 92 all’uranio. Il numero atomico di un elemento corrisponde al conteggio dei protoni. Anche se tutti gli elementi, tranne l’idrogeno, hanno bisogno di alcuni neutroni per mantenere insieme i protoni, è il numero di protoni che determina le proprietà chimiche dell’elemento.
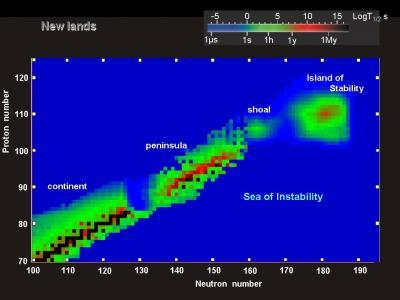
La tavola periodica è stata inizialmente costruita basandosi sugli elementi naturalmente presenti e riempita fino all’uranio. Gli elementi con più di 92 protoni non venivano trovati in natura, quindi gli scienziati hanno iniziato a crearli artificialmente, dando vita agli elementi sintetici. Finora sono stati creati 26 di questi elementi transuranici, tutti radioattivi e instabili.
La produzione dei primi elementi transuranici come neptunio e plutonio è stata relativamente semplice, ma man mano che si è avanzati lungo il settimo periodo, la creazione di nuovi elementi è diventata sempre più difficile. Alcuni elementi come il Roentgenio e il Darmstadtio hanno emivite misurate in pochi secondi, mentre il Moscovio ha una emivita misurata in millisecondi, rendendo difficile lo studio della sua chimica.
Dal 2010 non sono stati annunciati nuovi elementi, ma non c’è un motivo teorico per cui elementi più pesanti non dovrebbero essere possibili. Anche se la creazione di nuovi elementi potrebbe diventare sempre più difficile, non esiste un limite assoluto alla possibilità di scoprirne altri.
Un’interessante prospettiva è data dall’ipotesi di un’isola di stabilità intorno al numero atomico 164, dove elementi estremamente pesanti potrebbero essere stabili per lunghi periodi di tempo. Questa teoria ha ricevuto un impulso da recenti scoperte di asteroidi densi come 33 Polimnia e Psyche, che potrebbero essere formati attorno a nuclei di elementi vicini a questa presunta isola di stabilità.
Se fosse confermata, questa ipotesi potrebbe aprire la strada alla creazione di elementi con numeri atomici fino ai 170, al di là dell’isola di stabilità, ma comunque possibili da produrre per brevi periodi. Il futuro della tavola periodica potrebbe ancora riservare sorprese e nuove scoperte nel campo della chimica degli elementi. Per ulteriori approfondimenti, puoi consultare questo articolo e questo studio sulla chimica degli elementi superpesanti.